Descargar
PROYECTO QUIMICA ORT DEL GENOMA HUMANO
Investigacion en Bioquimica Molecular y Proteómica 2008
Por cuarto año consecutivo los alumnos del ultimo año de la especialidad Quimica de la escuela ORT Argentina realizaran sus proyectos finales en distintas universidades y centros de investigacion con profesionales reconocidos. La metodologia de trabajo evita la transposicion didactica permitiendo a los estudiantes realizar su actividad final en los lugares donde se esta generando el conocimiento.
La articulacion entre nivel medio y el posgrado es auspiciada por el CONICET (Consejo Nacional De Investigacion Cientifica...).
Los proyectos de investigacion para el año en curso son:
1) Evaluacion de la expresion de la molecula de adhesion Cadherina epitelial en tejidos humanos normales y tumolares.
Investigador:Doctora monica Vazquez-Levin.
Instituto de Biologia y Medicina Molecular ( IBYME-CONICET).
Alumnos: Yael Dobzewicz y Gala Szapiro.
Link: http://www.proyecto-6q.blogspot.com/
2) Accion del Hexaclorobenceno (HCB) sobre la Uroporfirinogeno Decarboxilasa de una linea celular de Hepatocitos humanos. Mecanismo de accion.
Investigador:Doctora Maria del Carmen Rios de Molina.
Instituto: Departamento Quimica Biologica, Facultad de Ciencias Exactas y Naturales.
Alumnos: Lucas Toiw y Uriel Frid.
Link: http://www.proyectofird-toiw08.blogspot.com/
3)Modelos experimentales de enfermedades metabólicas: Porfiria y Síndrome Metabólico. Proteómica y Metabolómica de estos disturbios.
Investigador: Dra. Marta Blanca Mazzetti.
Instituto: Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales (UBA). Alumnos: Maria Duperron y Mauro Elencwajg.
Link: http://proyectofinal6q.blogspot.com/
4) Factores no hemodinámicos relacionados con la génesis y evolución de la proteinuria durante la enfermedad renal progresiva.
Investigador: Dra. Elsa Zotta.
Instituto: Laboratorio de Fisiopatogénia, Departamento de fisiología, Facultad de medicina, UBA. Alumnos: Barbara Helueni y Melanie Naiman.
Link: http://proyectoq08.blogspot.com/
5) Estudio de la participacion de la anandamida en la regulacion de la interaccion espermatozoide-ovioducto en un modelo bovino.
Investigador: Dra. Silvina Perez Martinez.
Instituto: Facultad de medicina - UBA
Alumnos: Judith Arenas Tenenbaum y Melina Braverman
Link: http://www.scienceproject08.blogspot.com/
6) El estudio de los mecanismos moleculares involucrados en la regulación del gen UGA4 de Saccharomyces cervisiae en respuesta a cambios en la disponibilidad de nutrientes con el fin de dilucidar las distintas cascadas de señales desencadenadas por dichos nutrientes y establecer sus interconexiones.
Investigador: Dra Susana Correa García.
Instituto: Departamento de Química Biologica, Facultad de ciencias Exactas y Naturales, Universidad de Buenos Aires.
Alumnos: Iván Mikiej y Victoria Salama
Link: http://www.proyectoquimica22.blogspot.com/
7) Diagnóstico de la enfermedad de Von Willebrand (VWD) tipo 2N por técnicas fenotípicas y genotípicas.
Investigador: Dra. Adriana I. Woods.
Instituto: Instituto de Investigaciones Hematológicas "Mariano R. Castex" de la Academia Nacional de Medicina.
Alumnos: Abigail Skverer y Daniela Lin
Link: http://www.vwd-diagnostico.blogspot.com/
8) Estudio de la mielinogenesis en el sistema nervioso periferico en condiciones fisiologicas y patologicas. Participacion de celulas pluripotentes en el proceso de degeneracion-regeneracion nerviosa.
Investigador: Dra Patricia Setton-Avruj.
Instituto: Dpto de Quimica Biologica, Facultad de Farmacia y Bioquimica (IQUIFIB-UBA-CONICET).
Alumnos: Averbuj Daniel y Eitan Rozenszajn.
Link: http://www.proyectoaverbuj-rozenszajn.blogspot.com/
9) Diseño y desarrollo de vacunas antitumorales empleando bacterias y celulas tumorales modificadas con genes inmunomodiladores. Estudio de los mecanismos inmunes inducidos.
Investigador: Claudia I. Waldner y Claudia Mongini.
Instituto: Laboratorio de inmunologia celular y molecular. Centro de Estudios Farmacologicos y Botanicos (CEFYBO. CONICET-UBA)
Alumnos: Amalia Surijon y Maria Belen Tolava Rivero
Link: http://www.amibeluproyecto.blogspot.com/
10) Marcadores Geneticos Asociados al Cáncer
Investigador: Dr.Javier Hernán Cotignola
Instituto: Laboratorio de Cáncer y Apoptosis del Departamento de Quimica Biologica de la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires.
Alumnos: Ayelén Marano y Solange Perchik
Link: http://marcadoresgeneticos.blogspot.com/
11) Expresion del canal de la conductancia transmembranal de la Fibrosis Quistica (CFTR) en placentas Preeclampticas: posible rol en la regulacion de la actividad de la Acuoporina-9 (AQP9).
Investigador: Dr Alicia E Damiano
Instituto: Catedra de Biologia Celular, Departamento de Ciencias Biologicas, Facultad de Farmacia y Bioquimica (UBA)
Alumnos: Gabriel Colodenco y Martín Sapir.
Link: http://proyectofinalcs.blogspot.com/
12) Proteómica de factores secretados por células de cáncer de mama y mama normal con capacidad inhibitoria de la producción lipídica.
Investigador: Dra.Guerra de Grignoli Liliana Noemi
Instituto: Departamento de Ciencias biologicas. Facultad de ciencias exactas y naturales,UBA-CONICET.
Alumnos: Fabiana Durante y Tamara Broitman.
Link: http://tyf-proyecto08.blogspot.com/
13) Neovascularizaciòn en un modelo murino de inflamaciòn aguda inducida por LPS.
Investigador:Eulalia de la Torre.
Instituto: Facultad de Medicina - Uba - Laboratorio de Inmunofarmacologia
Alumnos: Federico Mauas Walach, Pablo Kuleff.
Link: http://www.finalproyectort.blogspot.com/
14) Interacción de sumo-1 y mage-a2 en la regulacion del oncosupresor p53
Investigador: Martín Monte
Instituto: Facultad de Ciencias Exactas y Naturales (UBA)
Alumnos: Leonel Stermann y Yair Litman
Blog: http://proyectosumo.blogspot.com/
15) Estudio de la Growth Associated Protein (GAP-43), su interacción con la Ubicutina y su participación en el control del ciclo celular en células NIH3T3 transfectadas en forma estable y transiente. Efecto de la Apo-transferrina en la remielización: participación de la vía Notch en la diferenciación oligodendrioglial.
Investigador: Doctora Ana M. Adamo.
Instituto: Departamento de Química Biológica Patológica, Facultad de Farmacia y Bioquímica de la UBA. CONICET.
Alumnos: Rodrigo C. Pampin y Robby Mattes
Link: http://www.gap-43.blogspot.com/
Por cuarto año consecutivo los alumnos del ultimo año de la especialidad Quimica de la escuela ORT Argentina realizaran sus proyectos finales en distintas universidades y centros de investigacion con profesionales reconocidos. La metodologia de trabajo evita la transposicion didactica permitiendo a los estudiantes realizar su actividad final en los lugares donde se esta generando el conocimiento.
La articulacion entre nivel medio y el posgrado es auspiciada por el CONICET (Consejo Nacional De Investigacion Cientifica...).
Los proyectos de investigacion para el año en curso son:
1) Evaluacion de la expresion de la molecula de adhesion Cadherina epitelial en tejidos humanos normales y tumolares.
Investigador:Doctora monica Vazquez-Levin.
Instituto de Biologia y Medicina Molecular ( IBYME-CONICET).
Alumnos: Yael Dobzewicz y Gala Szapiro.
Link: http://www.proyecto-6q.blogspot.com/
2) Accion del Hexaclorobenceno (HCB) sobre la Uroporfirinogeno Decarboxilasa de una linea celular de Hepatocitos humanos. Mecanismo de accion.
Investigador:Doctora Maria del Carmen Rios de Molina.
Instituto: Departamento Quimica Biologica, Facultad de Ciencias Exactas y Naturales.
Alumnos: Lucas Toiw y Uriel Frid.
Link: http://www.proyectofird-toiw08.blogspot.com/
3)Modelos experimentales de enfermedades metabólicas: Porfiria y Síndrome Metabólico. Proteómica y Metabolómica de estos disturbios.
Investigador: Dra. Marta Blanca Mazzetti.
Instituto: Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales (UBA). Alumnos: Maria Duperron y Mauro Elencwajg.
Link: http://proyectofinal6q.blogspot.com/
4) Factores no hemodinámicos relacionados con la génesis y evolución de la proteinuria durante la enfermedad renal progresiva.
Investigador: Dra. Elsa Zotta.
Instituto: Laboratorio de Fisiopatogénia, Departamento de fisiología, Facultad de medicina, UBA. Alumnos: Barbara Helueni y Melanie Naiman.
Link: http://proyectoq08.blogspot.com/
5) Estudio de la participacion de la anandamida en la regulacion de la interaccion espermatozoide-ovioducto en un modelo bovino.
Investigador: Dra. Silvina Perez Martinez.
Instituto: Facultad de medicina - UBA
Alumnos: Judith Arenas Tenenbaum y Melina Braverman
Link: http://www.scienceproject08.blogspot.com/
6) El estudio de los mecanismos moleculares involucrados en la regulación del gen UGA4 de Saccharomyces cervisiae en respuesta a cambios en la disponibilidad de nutrientes con el fin de dilucidar las distintas cascadas de señales desencadenadas por dichos nutrientes y establecer sus interconexiones.
Investigador: Dra Susana Correa García.
Instituto: Departamento de Química Biologica, Facultad de ciencias Exactas y Naturales, Universidad de Buenos Aires.
Alumnos: Iván Mikiej y Victoria Salama
Link: http://www.proyectoquimica22.blogspot.com/
7) Diagnóstico de la enfermedad de Von Willebrand (VWD) tipo 2N por técnicas fenotípicas y genotípicas.
Investigador: Dra. Adriana I. Woods.
Instituto: Instituto de Investigaciones Hematológicas "Mariano R. Castex" de la Academia Nacional de Medicina.
Alumnos: Abigail Skverer y Daniela Lin
Link: http://www.vwd-diagnostico.blogspot.com/
8) Estudio de la mielinogenesis en el sistema nervioso periferico en condiciones fisiologicas y patologicas. Participacion de celulas pluripotentes en el proceso de degeneracion-regeneracion nerviosa.
Investigador: Dra Patricia Setton-Avruj.
Instituto: Dpto de Quimica Biologica, Facultad de Farmacia y Bioquimica (IQUIFIB-UBA-CONICET).
Alumnos: Averbuj Daniel y Eitan Rozenszajn.
Link: http://www.proyectoaverbuj-rozenszajn.blogspot.com/
9) Diseño y desarrollo de vacunas antitumorales empleando bacterias y celulas tumorales modificadas con genes inmunomodiladores. Estudio de los mecanismos inmunes inducidos.
Investigador: Claudia I. Waldner y Claudia Mongini.
Instituto: Laboratorio de inmunologia celular y molecular. Centro de Estudios Farmacologicos y Botanicos (CEFYBO. CONICET-UBA)
Alumnos: Amalia Surijon y Maria Belen Tolava Rivero
Link: http://www.amibeluproyecto.blogspot.com/
10) Marcadores Geneticos Asociados al Cáncer
Investigador: Dr.Javier Hernán Cotignola
Instituto: Laboratorio de Cáncer y Apoptosis del Departamento de Quimica Biologica de la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires.
Alumnos: Ayelén Marano y Solange Perchik
Link: http://marcadoresgeneticos.blogspot.com/
11) Expresion del canal de la conductancia transmembranal de la Fibrosis Quistica (CFTR) en placentas Preeclampticas: posible rol en la regulacion de la actividad de la Acuoporina-9 (AQP9).
Investigador: Dr Alicia E Damiano
Instituto: Catedra de Biologia Celular, Departamento de Ciencias Biologicas, Facultad de Farmacia y Bioquimica (UBA)
Alumnos: Gabriel Colodenco y Martín Sapir.
Link: http://proyectofinalcs.blogspot.com/
12) Proteómica de factores secretados por células de cáncer de mama y mama normal con capacidad inhibitoria de la producción lipídica.
Investigador: Dra.Guerra de Grignoli Liliana Noemi
Instituto: Departamento de Ciencias biologicas. Facultad de ciencias exactas y naturales,UBA-CONICET.
Alumnos: Fabiana Durante y Tamara Broitman.
Link: http://tyf-proyecto08.blogspot.com/
13) Neovascularizaciòn en un modelo murino de inflamaciòn aguda inducida por LPS.
Investigador:Eulalia de la Torre.
Instituto: Facultad de Medicina - Uba - Laboratorio de Inmunofarmacologia
Alumnos: Federico Mauas Walach, Pablo Kuleff.
Link: http://www.finalproyectort.blogspot.com/
14) Interacción de sumo-1 y mage-a2 en la regulacion del oncosupresor p53
Investigador: Martín Monte
Instituto: Facultad de Ciencias Exactas y Naturales (UBA)
Alumnos: Leonel Stermann y Yair Litman
Blog: http://proyectosumo.blogspot.com/
15) Estudio de la Growth Associated Protein (GAP-43), su interacción con la Ubicutina y su participación en el control del ciclo celular en células NIH3T3 transfectadas en forma estable y transiente. Efecto de la Apo-transferrina en la remielización: participación de la vía Notch en la diferenciación oligodendrioglial.
Investigador: Doctora Ana M. Adamo.
Instituto: Departamento de Química Biológica Patológica, Facultad de Farmacia y Bioquímica de la UBA. CONICET.
Alumnos: Rodrigo C. Pampin y Robby Mattes
Link: http://www.gap-43.blogspot.com/
domingo, 17 de agosto de 2008
Semana 12 (14 de Agosto)
Después de una larga ausencia, a causa de las vacaciones de invierno, nos sentamos junto a nuestra investigadora, Patricia Setton-Avruj a hacer la última revisión de la introducción para así dejarla lista, además de también reforzar ciertos conceptos teóricos.
Semana 11 (24 de Julio)
Hoy se sacrificó a uno de los animales con 7 días de sobrevida, para el análisis de su mielina. A diferencia de otras extracciones del nervio ciático, esta vez le extrajimos a la rata de la pata que tenía el nervio ciático injuriado (ipsilateral) y el nervio ciático sano (contralateral). Le extrajimos a una sola rata, para analizar una que tenga sobrevida de 7 días, y en futuros experimentos utilizaremos la segunda rata, para analizar una mayor sobrevida. En este caso le sacamos ex nervio contralateral que pesaba: 20 mg.
Pero la parte ipsilateral la dividimos en dos partes: La parte del nervio que está conectada a la medula espinal hacia la parte injuriada, se llama zona proximal, y en este caso pesa 8,10 mg. La otra parte mas alejada de la medula se llama distal. Esta última pesa 11,60 mg. Este día preparamos las respectivas soluciones de sacarosa (ya nombradas en otro día que vinimos aquí.) centrifugamos y obtuvimos el pellet. No llegamos a hacer las correspondientes mediciones espectrofotométricas (que se realizará en otro día). La idea de este experimento es comparar la composición proteica de la mielina normal del nervio contralateral, y de las correspondientes a la zona proximal y distal
Pero la parte ipsilateral la dividimos en dos partes: La parte del nervio que está conectada a la medula espinal hacia la parte injuriada, se llama zona proximal, y en este caso pesa 8,10 mg. La otra parte mas alejada de la medula se llama distal. Esta última pesa 11,60 mg. Este día preparamos las respectivas soluciones de sacarosa (ya nombradas en otro día que vinimos aquí.) centrifugamos y obtuvimos el pellet. No llegamos a hacer las correspondientes mediciones espectrofotométricas (que se realizará en otro día). La idea de este experimento es comparar la composición proteica de la mielina normal del nervio contralateral, y de las correspondientes a la zona proximal y distal
Semana 10 (17 de Julio)
Nosotros ya teníamos el gel preparado de la semana pasada. Hoy nos encargamos de largar la corrida electroforética propiamente dicha:
Nosotros sabíamos que nuestra cantidad de proteínas por unidad de volumen era:
Nosotros sabíamos que nuestra cantidad de proteínas por unidad de volumen era:
Entonces sabiendo que se desea sembrar siempre la misma cantidad de proteínas, para que en la corrida, la diferencias esten dadas por las diferente composición de las muestras o las diferentes situaciones experimentales y no por la cantidad sembrada. Entonces de todos estos se siembra solo 40 ug de proteínas. El volumen que se deberá sembrar de cada uno para llegar a los 40 ug será:
Entonces el volumen total de siembra para cada caso será:
Luego a cada uno se le debe agregar un volumen de buffer Laemmli que equivalga a la cuarta parte del volumen de cada muestra; en este caso:
Entonces el volumen total de siembra para cada caso será:
Una vez hecho esto se lleva a ebullición para desnaturalizar por completo a las proteínas, y de esta forma asegurarse que las diferentes bandas que vayan a dar en la electroforesis se deba al peso molecular de la proteína y no a su forma globular u otra estructura terciaria que haga que el resultado en verdad difiera. Las proteínas deben tener únicamente su estructura primaria, es decir, su cadena extendida de aminoácidos, la cadena polipeptídica.
Habiendo realizado los pasos previos, introdujimos el gel en la cuba electroforética para la posterior realización de la corrida.
El gel esta armado de tal manera que nos quedan 4 calles con la siembra de nuestras 4 muestras y la primera calle con el marker (mezcla de proteínas con peso molecular conocido, del cual se siembran solo 5 ul):
El voltaje inicial con el cual se debe comenzar la electroforesis es de 50 V. Luego de que la corrida haya pasado el Stacking, el voltaje se cambia a 100V
Lamentablemente no pudimos sacar una foto del gel listo, sin embargo un dibujo de lo observado sería:
Lamentablemente no pudimos sacar una foto del gel listo, sin embargo un dibujo de lo observado sería:
Este mismo día operamos 2 animales realizando una compresión nerviosa en cada uno para poder dejarlos 7 días de sobrevida y luego analizar los cambios ocurridos; para esto debimos hacer el mismo procedimiento que con la extracción del nervio pero con el animal vivo, anestesiado y cuidando al esterilidad del proceso para que la injuria sea exitosa, ya que de haber muerto el animal, habría sido en vano.
Semana 9 (10 de Julio)
Hoy preparamos por primera vez un gel de poliacrilamida, para hacer la corrida electroforética de nuestras proteínas de la mielina extraída. Preparamos un gel al 12,5 % de poliacrilamida, de acuerdo al siguiente protocolo:
Luego de esperar alrededor de media hora para que gelifique, se agrega por sobre éste el stacking donde se colocara el peine durante el proceso de gelificacion y que contiene los pocillos en los que se cargarán las muestras para que entren al gel de corrida de manera simultánea.
Stacking:
Una vez preparado el gel lo dejamos en la heladera hasta la semana siguiente para que se conserve de manera adecuada hasta el momento de realizar la corrida.
Semana 8 (3 de Julio)
Continuamos con la cuantificación de las proteínas en la muestra de mielina que extrajimos el 19/6.


Primero de todo medimos el volumen de mielina aislada que obtuvimos:
(Las celdas tachadas indican valores de transmitancia porcentual que es muy imprecisa, y no están cerca de los otros dos valores, por lo que no pueden ser promediables. Por este motivo el promedio se tomó con los dos valores mas cercanos entre si en esos casos)
Aplicando la ecuación de la curva de calibración se obtiene los microgramos de proteínas en 5 ul tomados:

Entonces podemos informar el resultado de proteínas de mielina por unidad de tejido como sigue:

Semana 7 (26 de Junio)
Este día Daniel estuvo enfermo por lo que debió ausentarse, en cuanto a mi, Eitan, junto a Patricia, realizamos una corrección general del blog y luego de esto observe la realización de una inmunocitoquímica por las becarias del laboratorio.
Semana 6 (19 de Junio)
Lanzamos nuestra primera extracción y aislamiento de mielina.
Para comenzar desde cero comenzamos por preparar soluciones de distinta concentración de sacarosa para realizar los gradientes de concentración.
Mr(sacarosa) = 342.3 g/mol
342.3g/mol x2mol = 684.6g
Preparamos 100 ml una solución 2M y a partir de esta hicimos diluciones para obtener soluciones 0.85M y 0.32M
684.6 g --------------------1000 ml
68.46 g=x------------------100 ml
Para preparar cada una de las diluciones a partir de la solución 2M, hicimos:
Sabiendo que en una dilución el nº de moles no cambia utilizamos:
M1 x V1 = M2 x V2
Para preparar 30 ml de una solución 0.85 M
V1 = (30 ml x 0,85 M)/2 M
V1 = 12.75 ml
Y para preparar 15 ml de una solución 0.32 M hicimos:
V1 = (15 ml x 0,32 M)/2 M
V1 = 2.40 ml
Armamos el siguiente gradiente de concentración:
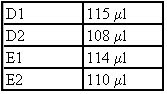
Los distintos tonos de gris indican las distintas fases con las soluciones de distintas concentraciones. Se ve mas claramente la diferencia entre 2 M y 0,85 M. Entre 0, 85 M y 0,32 m recién se ve cuando se agrega el homogenato de nervio.Luego de finalizados los gradientes, extrajimos el nervio ciático del animal muerto, y luego de esto pesamos cada nervio:
D1 --> 40,60 mg
D2 --> 36,50 mg
E1 --> 25,90 mg
E2--> 51,20 mg
Las letras D y E corresponden a nuestros nombres ya que cada uno tuvo su animal al cual extraerle el nervio.
Luego de pesados cada uno de los nervios, los disgregamos con tijeras para luego homogeneizarlos en 2ml de una solución de sacarosa 0.32M
Pasamos los homogenatos a los tubos con los gradientes y los colocamos en adaptadores del rotor swinging SW28 para luego centrifugarlos a 25000rpm a 4º C por 45 minutos.
Es importante recordar que, al ser llevados a 25000 rpm los adaptadores deben pesar exactamente lo mismo para que, por la velocidad, no salgan disparadas o se desbalanceen causando algún desperfecto en la centrifuga.
Pasados los 45 minutos, retiramos los tubos de los adaptadores viendo como resultado que en la interfase entre el gradiente de 0.85 M y 0.32 M queda flotando la mielina en forma de anillo el cual extrajimos con una micro pipeta y llevamos a volumen en otro tubo con agua fría y se lo deja reposar 20 minutos. Este proceso se llama shock de mielina.
Finalizado el tiempo de reposo se lo centrífuga 20 minutos a 10000 rpm y el pellet que se obtiene es la mielina purificada.
Semana 5 (12 de Junio)
Esta semana corrimos una electroforesis de la cadena de ADN obtenida la semana anterior:
Para la técnica se debe prepara un gel de la siguiente manera:
· Pesar aproximadamente 0,400 g de agarosa
· diluir en buffer de triboratos
· Como la agarosa debe estar completamente disuelta en el buffer y como a temperatura ambiente esta no es totalmente soluble, se la calienta en un microondas hasta ebullición del buffer
· colocar el líquido rápidamente, evitando la gelificacion prematura de del mismo.Luego de preparado el gel, se procede a la corrida electroforética:· tomar el cassette para el gel de agarosa que se utiliza para PCR y agregar una pizquita de bromuro de etidio (extremadamente carcinogénico y tóxico, hay que tener sumo cuidado, trabajando con guantes, estos no deben tocar nada) y distribuirla uniformemente en el gel, que aun no ha gelificando completamente.
· Dejar aproximadamente 25 minutos gelificando.· Luego observamos como corría la electroforesis:
Vale aclarar que esto se hizo con la intención de saber si había habido un error en los procedimientos anteriores ya que la primer corrida arrojo un resultado incorrecto. Para encontrar ese error se realizo una nueva corrida cambiando el buffer (ya que se creía que el mismo estaba contaminado) Y al ver que el control negativo amplifico al no tener que hacerlo significa que la contaminación se encuentra en los primers o en los oligonucleótidos.
1--> nada
2--> muestra P4 con buffer viejo
3--> control negativo con buffer viejo
4--> muestra P4 con buffer nuevo
5--> control negativo buffer nuevo
Semana 4 (5 de Junio)
Esta semana Eitan debió ausentarse por lo que yo, Daniel, luego de una breve explicación teórica de Patricia, realicé una cuantificación de proteínas.
Determinación de proteínas por el método de Lowry
El método de Lowry se basa en una reacción calorimétrica para la determinación de proteínas. Al añadirle el reactivo (folin) a una muestra de las mismas se forma un complejo coloreado del cual es posible medir la transmitancia mediante un espectrofotómetro, que, según la ley de Lambert-Beer, la intensidad del color de la disolución resultante es proporcional a la concentración de proteínas. Para determinar la concentración de proteínas de la muestra incógnita se construye una curva de calibración a partir de una solución de albúmina de suero bovino (2 mg/ml). La concentración que tiene la muestra incógnita se determina por interpolación de los valores de absorbancia en la curva patrón. El blanco, que sólo contiene agua destilada y los reactivos, sirve para el ajuste del espectrofotómetro a cero de absorbancia (100% T).
Procedimiento:
· Si el volumen de las alícuotas de muestras o Standard es alto se debe evaporar a sequedad en baño de 60ºC
Este método consta de dos etapas:
2) La reducción, también en medio básico, del reactivo de Folin-Ciocalteau por los grupos fenólicos de los residuos de tirosina presentes en la mayoría de las proteínas, actuando el cobre como catalizador. El principal constituyente del reactivo de Folin‑Ciocalteau es el ácido fosfomolibdotúngstico, de color amarillo, que al ser reducido por los grupos fenólicos da lugar a un complejo de color azul intenso.
Determinación de proteínas por el método de Lowry
El método de Lowry se basa en una reacción calorimétrica para la determinación de proteínas. Al añadirle el reactivo (folin) a una muestra de las mismas se forma un complejo coloreado del cual es posible medir la transmitancia mediante un espectrofotómetro, que, según la ley de Lambert-Beer, la intensidad del color de la disolución resultante es proporcional a la concentración de proteínas. Para determinar la concentración de proteínas de la muestra incógnita se construye una curva de calibración a partir de una solución de albúmina de suero bovino (2 mg/ml). La concentración que tiene la muestra incógnita se determina por interpolación de los valores de absorbancia en la curva patrón. El blanco, que sólo contiene agua destilada y los reactivos, sirve para el ajuste del espectrofotómetro a cero de absorbancia (100% T).
Procedimiento:
· Si el volumen de las alícuotas de muestras o Standard es alto se debe evaporar a sequedad en baño de 60ºC
·Agregar 0,2 ml de agente hidrolizante (NaOH 0,5 N para citosol y microsomas, NaOH 0,5 N con SDS al 2% para mielina), vortexear e incubar a temperatura ambiente (15 minutos para citosol y microsomas, 30 minutos para mielina)
· Agregar 1 ml de solución de tartrato de cobre preparada en el momento:
Na2 CO3 al 2%-----------------------------49.0 ml 20, 0 ml 30,0 ml 40,0 ml
Cu SO4 x 5 H2O al 1% -----------------1,0 ml 0,4 ml 0,6 ml 0,8 ml
Vortexear y dejar reposar 10 minutos a temperatura ambiente.
· Agregar 0,1 ml de reactivo de folin (diluir en el momento 1/3), agitando tubo por tubo y dejar 30 minutos a temperatura ambiente.
· Leer en el espectrofotómetro a 750 nm.
Nota: la lectura en el espectrofotómetro debe ser hecha durante los primeros 60 minutos después de realizada la reacción ya que pasado este tiempo, pierde la estabilidad.
Este método consta de dos etapas:
1) Se le agrega tartrato de cobre II y carbonato de calcio (proporciona el medio alcalino). Los iones Cu2+, en medio alcalino, se unen a las proteínas formando complejos con los átomos de nitrógeno de los enlaces peptídicos. Estos complejos Cu2+-proteína tienen un color azul claro. Además, provocan el desdoblamiento de la estructura tridimensional de la proteína, exponiéndose los residuos de tirosina que van a participar en la segunda etapa de la reacción. El Cu2+ se mantiene en solución alcalina en forma de su complejo con tartrato.
2) La reducción, también en medio básico, del reactivo de Folin-Ciocalteau por los grupos fenólicos de los residuos de tirosina presentes en la mayoría de las proteínas, actuando el cobre como catalizador. El principal constituyente del reactivo de Folin‑Ciocalteau es el ácido fosfomolibdotúngstico, de color amarillo, que al ser reducido por los grupos fenólicos da lugar a un complejo de color azul intenso.
Antes de la lectura el aparato se ajusta al 100% de transmitancia con el blanco; de esa forma sólo se mide el color producido por las proteínas, puesto que se resta el color debido a los reactivos.
Para obtener los siguientes resultados, debimos realizar una curva de calibración, a partir de una muestra patrón de albúmina, y con la ecuación de dicha curva obtuvimos la cantidad de proteínas en cada muestra incógnita.
Como la concentración de proteínas en el hígado medida nos dio fuera del rango de la curva, es decir que estaba muy concentrado, deberemos diluir la muestra para que los valores de la muestra estén dentro de dicha curva de calibración, haciendo así que la experiencia tenga una mayor confiabilidad.
Este mismo día ayudé en la extracción de ARN mensajero de las células de Schwann:
Extracción de ARN mensajero de las Células de Schwann
Esta técnica difiere en que se tiene que tener el cuidado de no hablar, debiéndose usar barbijos, para evitar que actúen las ARNasas, enzimas que podrían llegar a digerir el ARN, perjudicando el trabajo.
Este mismo día ayudé en la extracción de ARN mensajero de las células de Schwann:
Extracción de ARN mensajero de las Células de Schwann
Esta técnica difiere en que se tiene que tener el cuidado de no hablar, debiéndose usar barbijos, para evitar que actúen las ARNasas, enzimas que podrían llegar a digerir el ARN, perjudicando el trabajo.
En el momento de matar al animal se lo rocía con alcohol, porque no se quiere ningún inconveniente con la extracción de ARN, como bacterias u otras contaminaciones que degraden el ARN.
Se procede a la extracción de las células de Schwann del mismo modo que en la extracción para el cultivo de las mismas explicadas en la entrada anterior.
Luego se continúa hasta obtener células de Schwann aisladas
· Se centrifuga 5’a 2000 rpm.
· se descarta el sobrenadante
· se resuspende el pellet con igual volumen de DMEM + 10% de FCS,
· resuspender con vortex con agitación suave, con golpecitos, NO usar pipeta de vidrio.
· Disgregación mecánica: se realizan 10 pasajes por aguja 21G y 10 por aguja de 24G
Hasta aquí describimos el aislamiento de las células de Schwann, a partir de las cuáles aislaremos el ARN.
En el proceso mismo de extracción del ARN, nosotros no estuvimos presentes.
Sabemos de todos modos que luego de su extracción se usa la enzima virosica, transcriptasa reversa, para obtener la cadena de ADN copy que es el gen sin los intrones, desde este ADN se obtendría por polimerización la cadena de ARN mensajero para la síntesis de la cadena polipeptídica.
Se siembran en placas de petri pequeña o mediana (dependiendo del número de células que tengamos).
Semana 3 (29 de Mayo)
Esta semana tuvimos una clase teórica en la cual Patricia nos explicó sobre lo que habíamos visto en al extracción de la semana pasada y luego siguió dándonos mas conceptos acerca del tema.
Semana 2 (22 de Mayo)
Obteniendo células de Schwann
Esta semana observamos como es la obtención de células de Schwann:Este procedimiento se realiza para obtener células de Schwann (CS) de nervios de animales de 4 días de vida, para poner en cultivo; se debe mantener la esterilidad ya que este cultivo será incubado en estufa por 7 días a 36,5 ºC, y en estas condiciones, si no se cuida la esterilidad durante el proceso, puede proliferar una amplia gama de bacterias.
Esta semana observamos como es la obtención de células de Schwann:Este procedimiento se realiza para obtener células de Schwann (CS) de nervios de animales de 4 días de vida, para poner en cultivo; se debe mantener la esterilidad ya que este cultivo será incubado en estufa por 7 días a 36,5 ºC, y en estas condiciones, si no se cuida la esterilidad durante el proceso, puede proliferar una amplia gama de bacterias.
1. Se disecan los nervios ciáticos, previamente extraídos del animal (ratas de 4 días de vida) teniendo la precaución de utilizar distinto material de cirugía para sacar la piel. A medida que se disecan los nervios se ponen en una placa de petri estéril en 2 ml de medio Dulbecco modificado (DMEM) cada 16 nervios.




2. Una vez disecados los nervios se cortan al menor tamaño posible con tijera y se transfiere la suspensión a un tubo cónico de 15 ml.
3. Para producir la digestión enzimática se agregan 50 ml de tripsina y 40 ml de colagenasa por cada 2 ml de DMEM.
Solución madre de tripsina: 10%. Concentración final: 0.25 p/v.
Solución madre de colagenasa: 1.5%. Concentración final: 0.03 p/v. Se incuba durante 30’a 37° C, agitando cada 10’con movimiento rotatorio.
Esto es lo que observamos en una de nuestras clases. A partir de este punto sigue la metodología hasta llegar a obtener CS aisladas.
EMPEZANDO EL PROYECTO
A modo de introducción, explicaremos brevemente de que se trata el proyecto.El grupo de trabajo que encabeza el proyecto titulado: "Estudio de la mielinogenesis en el sistema nervioso periférico en condiciones fisiológicas y patológicas. Participación de las células pluripotentes en el proceso de la degeneración-regeneración nerviosa" esta avocado al estudio de los mecanismos que pueden participar en el proceso de degeneración-regeneración en el sistema nervioso periférico.Basados en la experiencia, podemos ver que la evolución clínica luego de un daño a cualquier nervio periférico es insatisfactoria, a pesar de la alta capacidad de los mismos de regenerarse.Innovaciones en las técnicas de microcirugía han mejorado la respuesta al tratamiento de lesiones del nervio periférico, pero aun es complicada la recuperación de la función de dichos nervios; es a partir de esto que es de reconocida importancia el poder encontrar las terapias alternativas mediante el uso de factores de crecimiento o transplantes de fuentes celulares no neurales con potencial de diferenciación hacia progenies celulares neurales que ha adquirido enorme relevancia en años recientes.El sistema nervioso periférico, que a partir de ahora llamaremos SNP, encargado de transmitir el impulso nervioso, esta formado por axones mielinizados y no mielinizados, envueltos por células de schwann (CS) que son las encargadas de formar mielina en el SNP. Es importante recalcar que a diferencia del sistema nervioso central (SNC), el SNP tiene una alta capacidad de regeneración y es por eso que los estudios encargados de especificar los mecanismos involucrados en los procesos de degeneración-regeneración, así como la remielinizacion ¡tiene enorme importancia en base a su potencial uso terapéutico.Se eligió para la realización de los eludíos de este grupo de investigación el nervio ciática de la rata por ser un nervio periférico altamente mielinizado. Los experimentos se realizan en un modelo de mielinogenesis fisiológico como es la diferenciación de las CS durante el proceso de formación del embrión y el modelo de CS en cultivos que permute evaluar la diferenciación de las mismas “in vitro” considerando que las CS en cultivo sufren una desdiferenciación perdiendo marcadores de mielina como P0 y MBP, y aumentando los niveles de marcadores de CS inmaduras como GFAP y p75NRT.Al nacer las células de schwann se encuentran completamente maduras y divididas en 2 poblaciones: las mielinizantes y las no mielinizantes. Las células mielinizantes presentan marcadores proteicos específicos como la P0, glicoproteina integral de la membrana, exclusiva del SNP y que representa aproximadamente el 50% de la mielina, y las proteínas básicas de la mielina (MBP) las cuales son una familia de 4/5 proteínas producidas por el splicing alternativo de un único gen.En contraposición las CS no mielinizantes se asocian con axones de pequeños diámetros y no expresan las proteínas de la mielina, si que presentan marcadores como la GFAP (proteína acídica glial fibrilar) y el receptor de baja afinidad para el factor de crecimiento nervioso (p75NRT).Lo que intentaremos hacer nosotros, alumnos de secundaria, es generar el mayor aporte posible a este grupo de trabajo avocado a dicho proyecto el cual comprendemos de suma importancia para el avance de la comprensión de la participación de distinto tipo de células en la degeneración-regeneración de las células nerviosas.
Semana 1 (15 de Mayo)
Esta, nuestra primer semana de trabajo, comenzamos la visita con una reunión en conjunto con el grupo de Robby Mattes y Rodrigo Cesáreo Pampin y nuestras respectivas investigadoras Patricia Setton-Avruj y Ana Adamo en la cual nos introdujeron a ambos equipos de trabajo, vimos un poco de teoría pero mas que nada utilizamos este primer encuentro para conocernos y empezar este proyecto de una manera amena y amistosa. Ambas investigadoras nos introdujeron a sus líneas de investigación. Nos hablaron del proceso de mielinización tanto en el sistema nervioso central como en el periférico, tratamos acerca de las células responsables de ese proceso, los oligodendrocitos y las células de Schwann, como también de la interacción entre las neuronas, en particular sus axones y estas células.
Suscribirse a:
Comentarios (Atom)